
암석을 이루는 광물 중 가장 흔한 광물을 조암광물이라고 합니다. 대략 20여종의 조암광물이 있는데, 우리에게 가장 친숙한 아이들은 석영, 장석, 흑운모, 감람석, 휘석 대략 이런 아이들이 있습니다. 그리고 이런 조암광물 중에서도 SiO₄ 사면체로 구성되어 있는 아이들이 있는데, 이들을 규산염 광물이라고 합니다. 보통 학생들은 규산염 광물에 대한 특징, 종류 등을 시험을 위해 달달 외우기만 하다 보니 조금 안타까웠습니다. 오늘은 규산염 광물에 대해 교과서에서 다루지 않는 내용을 포함하여, 이들을 이해하는데 도움이 될 만한 여러가지 내용을 다루어 보고자 합니다.
** 함께 보면 좋을 글(보웬의 반응 계열)
보웬의 반응 계열 - 교과서에서 사라져버렸지만 매우 중요한
오래전 고등학교 지구과학 교과서에는 보웬의 반응계열(Bowen's reaction series)이 있던 시절이 있었습니다. 보웬의 반응계열은 대학 학부생들도 달달 외울만큼 엄청 중요한 내용입니다. 마그마에서
kalchi09.tistory.com
1. 기본구조
기본구조는 이미 여러 서적에서도 잘 알려져 있는 내용입니다. 4개의 산소가 1개의 규소를 둘러싼 공유결합 형태를 하고 있는 아이들입니다.

위 그림을 보면 쉽게 알 수 있습니다. 규산염 사면체를 나타낸 위 그림을 보면, 이온 상태의 산소 4개가 양이온 상태의 규소 주변으로 공유결합(좀 더 정확히는 배위결합)을 하고 있는 형태입니다. 산소에 의해 총 -8, 규소에 의해 총 +4이어서 규산염 사면체는 기본적으로 -4의 음전하를 띄게 됩니다. 이게 규산염 사면체의 가장 기본 단위가 됩니다.
규소 주변 사방의 산소가 모두 음이온 상태이니 만큼, 4개의 산소는 모두 양이온과 이온결합을 하게 되거나 경우에 따라 다른 규산염 사면체와 산소를 공유하는 형태로 결합하게 됩니다.
그래서 규산염 사면체 주변에 다른 규산염 사면체가 몇 개가 붙었느냐에 따라 독립사면체, 복사면체, 환상구조, 단쇄상 구조(단사슬 구조), 복쇄상 구조(복사슬 구조), 층상구조, 망상구조로 구분합니다. 이들에 대해 하나씩 알아보도록 하겠습니다. 바쁘신 분들을 위해 따로 요약한 그림을 먼저 띄웁니다.

2. 독립사면체
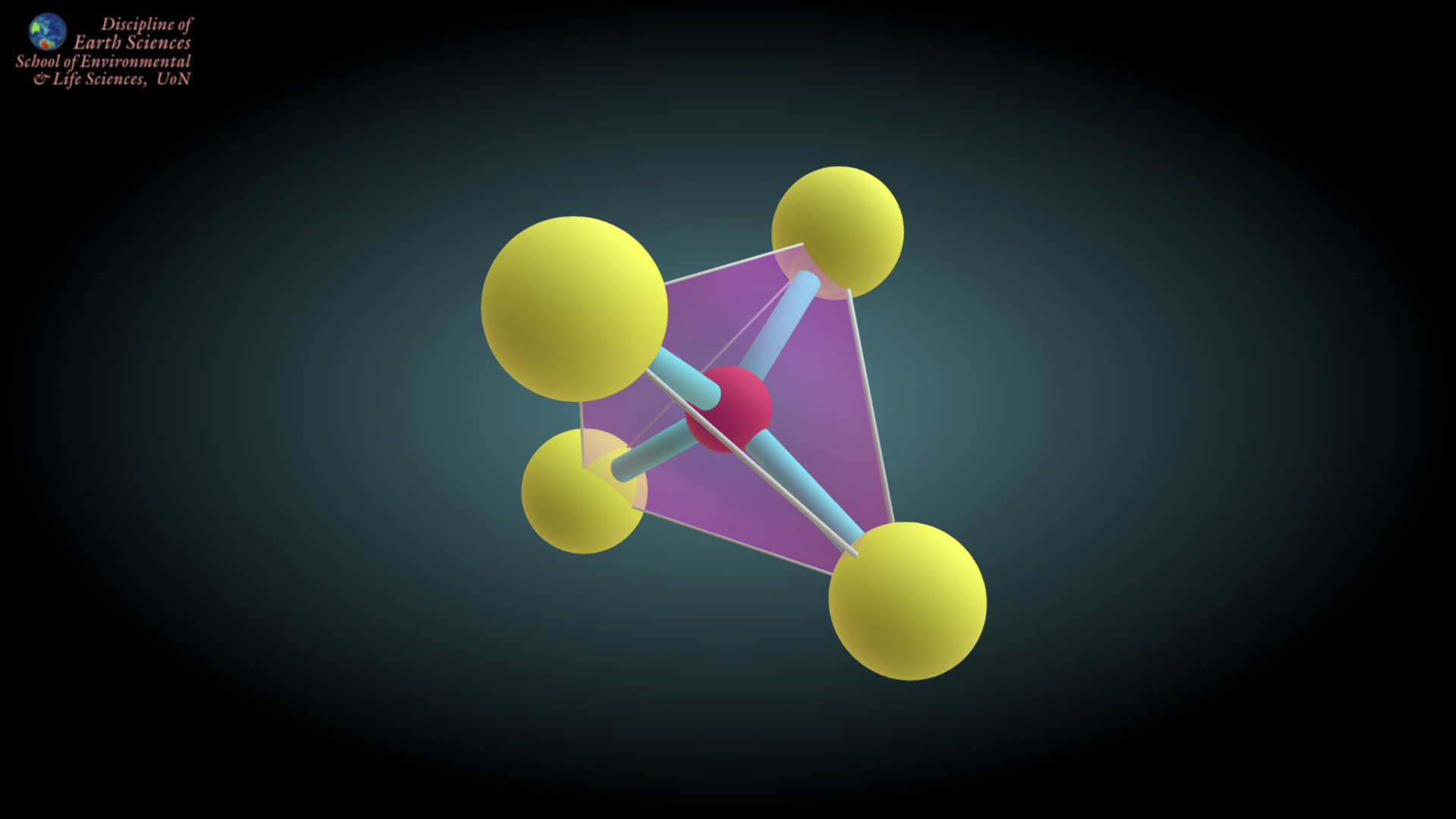
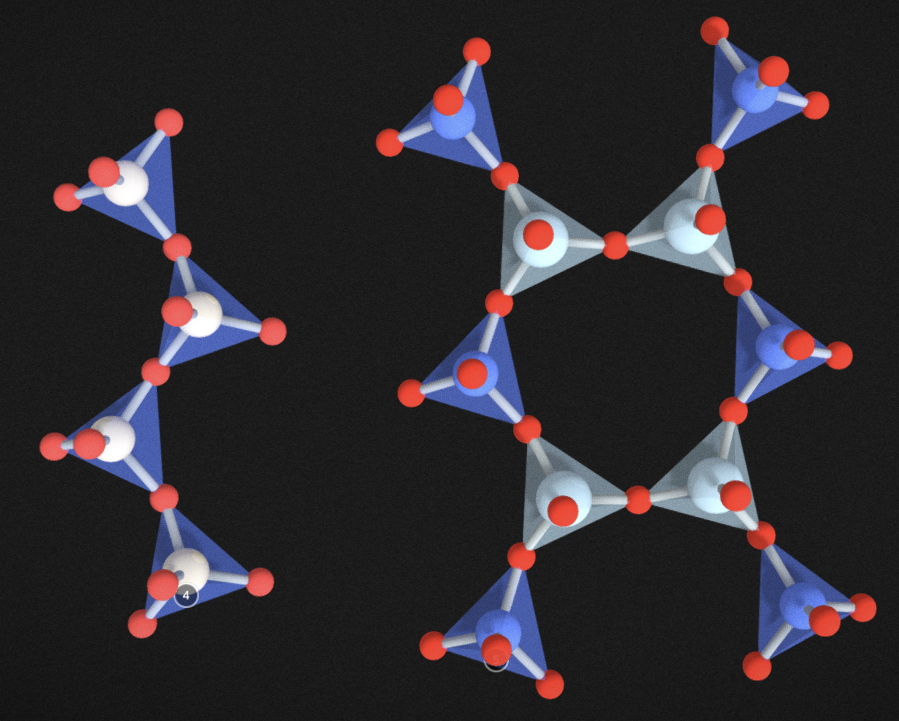
기본 규산염 사면체인 SiO4가 다른 사면체와 산소를 공유하는 형태를 띄지 않고, 단독으로 존재하는 경우입니다. 4개의 산소는 모두 주변의 양이온과 결합을 하고 있고, 이 양이온들은 다시 주변의 SiO4와 결합하고 있는 형태라 생각하시면 됩니다. 독립사면체의 대표적인 아이가 조암광물의 하나인 감람석과 석류석입니다. 아래 주소에서 감람석의 3D 모델을 보실 수 있습니다.
Fayalite - Download Free 3D model by WVU Volcanology and Petrology Lab - Sketchfab
Polyhedral model of fayalite (Fe2SiO4), the iron-rich olivine end-member. Model created in VESTA (https://jp-minerals.org/vesta/en/) with data from the American Mineralogist Crystal Structure Database (http://rruff.geo.arizona.edu/AMS/amcsd.php)
sketchfab.com
참고로 여기서 제공하는 감람석은 Fe- 감람석으로, 철 100%인 아이입니다(Fayalite) 참고로, 감람석은 철 100%이면 Fayalite, 마그네슘 100%이면 Forsterite 라고 불리며, 일반적인 감람석은 olivine라고 합니다. 이온 치환에 의한 화학식의 차이일 뿐, 결합 구조는 어느 놈이나 거의 비슷합니다.

위 그림에서 파란색 사면체가 SiO4 사면체인데, 저기서 빨간색 동그라미가 산소입니다. 보시면 알겠지만, 산소들은 그 주변에 갈색 팔면체 안의 동그라미(양이온, Fe)와 모두 결합되어 있습니다. 갈색 팔면체 안의 동그라미(Fe)은 다시 주변의 모든 산소와 붙어 있습니다. 주변의 모든 산소는 당연히 SiO4의 산소들이구요. 이런 형태로 무한히 결합되어있다 생각하면 됩니다.
사면체 1개의 기본 단위만 따지면, Si : O = 1 : 4로 단순합니다.
독립사면체 아이들은 보통 외력을 가했을 때 대부분 깨짐이 나타납니다. 산소와 양이온간의 이온결합은 결합력이 매우 약하고, 규산염 사면체 끼리 산소를 공유하는 결합은 결합이 굉장히 강한데, 감람석과 같은 독립사면체의 경우 사방이 모두 양이온과 결합한 형태여서 결합력이 약하여 깨짐이 나타난다 생각하면 됩니다.
3. 복사면체
복사면체와 환상구조는 고등학교 교과에서는 다루지 않지만, 이 아이들도 엄연한 규산염 광물이기 때문에 여기서는 잠시 소개하려 합니다.
Crystal structure of Lawsonite - 3D model by Museum of Mineralogy and Petrography, UAIC - Sketchfab
Mineral name: Lawsonite Formula: CaAl2(Si2O7)(OH)2 · H2O Classification: Silicates – Sorosilicates Crystal system: Orthorhombic Crystal class (Hermann-Mauguin): mmm (2/m 2/m 2/m) - Dipyramidal Space group: Ccmm Crystal data from Baur (1978) Note: The co
sketchfab.com
복사면체는 SiO4 사면체 두 개가 붙어 있는 형태입니다. 아래 그림은 복사면체 광물줄 로소나이트(lawsonite)라는 아이의 결정 구조입니다. 파란색 규산염 사면체 두 개가 딱 붙어 있습니다.
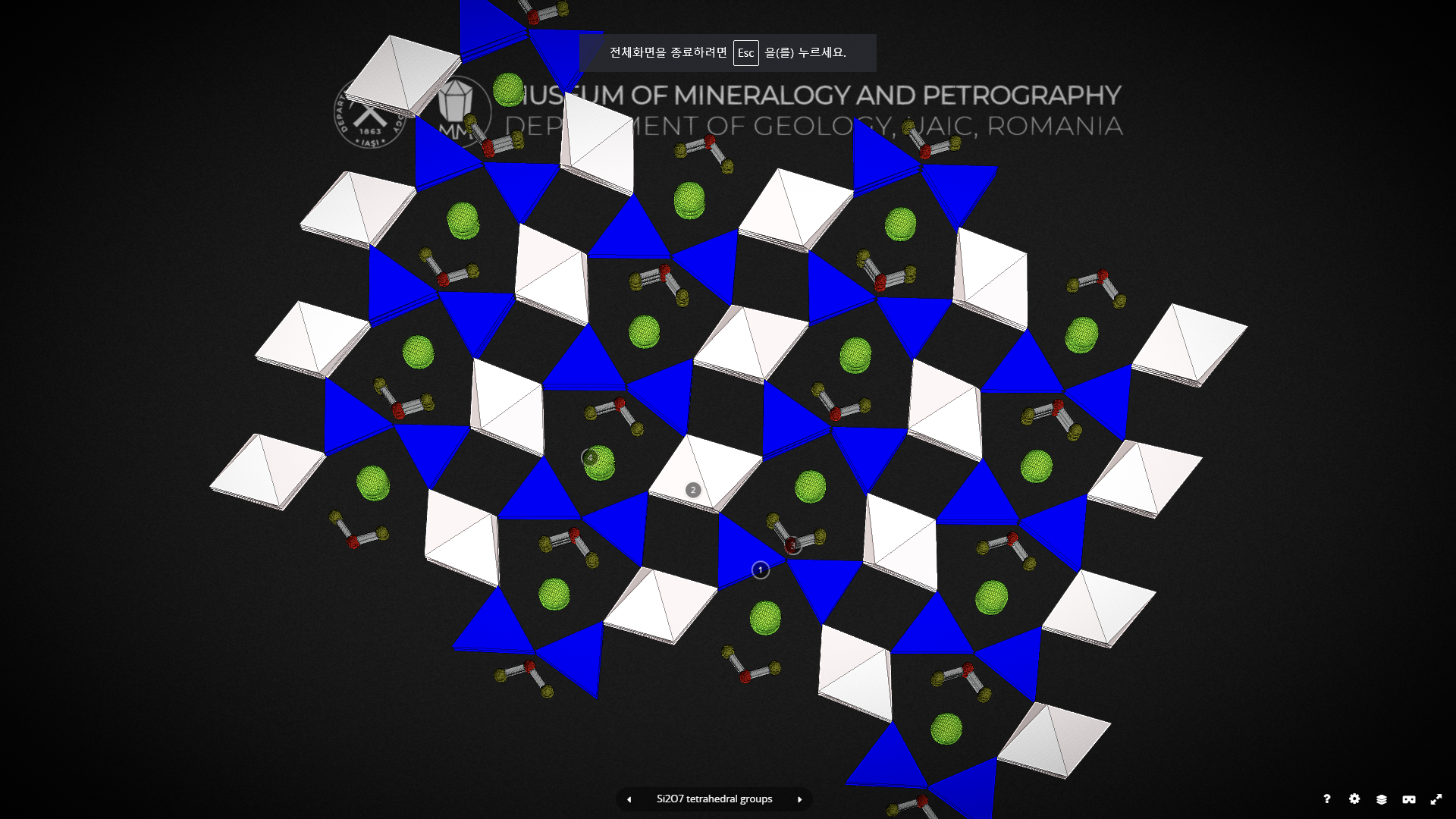
기본적으로 위 그림처럼 붙어 있고, 산소를 공유하고 있지 않는 곳은 모두 양이온이 붙어있다 생각하면 됩니다. 그리고 그 양이온은 다시 주변에 다른 규산염 사면체와 붙어있습니다. 이렇다 보니 하나의 기본단위에 총 7개의 산소가, 총 2개의 규소가 있어 Si : O = 2 : 7 이 됩니다. 복사면체 광물은 흔하지가 않습니다. 그래서 조암광물은 없고, 그나마 흔한 것이 녹염석이라는 아이입니다.
4. 환상구조
복사면체와 마찬가지로 이 아이도 교육과정에서는 배우지 않지만 어찌되었든 엄연한 규산염 광물이니까 이런 놈도 있구나 하는 정도로만 알아두시면 될 것 같습니다.
환상 구조는 규산염 사면체가 말 그대로 원형으로 배열된 것들인데, 3개가 배열된 3각 환상, 4개가 배열된 4각 환상, 6개가 배열된 6각 환상이 있습니다. 아래 그림은 6각 환상의 예입니다. 다른 규산염 광물들과 마찬가지로, 산소를 공유하지 않은 결합에는 모조리 양이온이 붙어 있습니다.
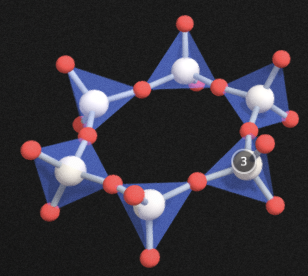
3각환상, 4각 환상은 6각 환상과 비교하였을 때 붙어있는 규산염 사면체의 갯수만 다릅니다. 규소와 산소의 비 Si : O = 1 : 3으로 모두 같습니다.
환상 구조를 보이는 광물은 진짜 드문 아이들입니다. 6각 환상에는 그나마 좀 보이는 아이들이 있는데, 녹주석, 근청석, 전기석이라는 예가 있습니다. 그나마도 이들 광물은 교육과정에서 거의 다루지 않습니다. 3각환상과 3각환상은 진짜 들어보지도 못한 것들입니다. 3각환상에는 베니토아이트, 4각 환상에는 파파고아이트라는 광물이 있습니다.
5. 단사슬구조(단쇄상구조)
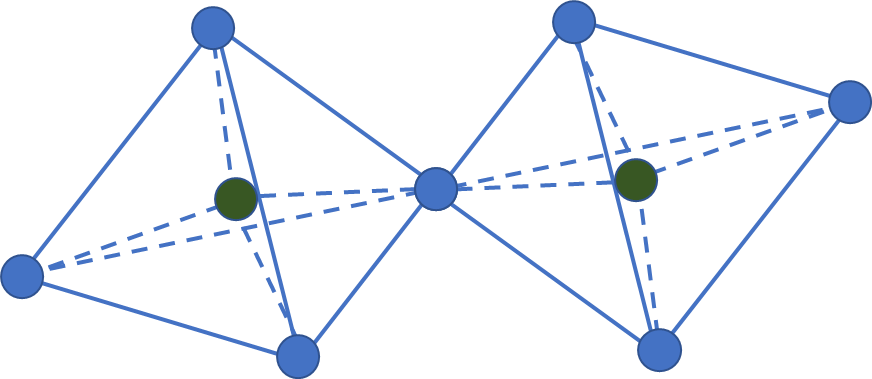
여기서부터는 엄청 중요한 광물들이 튀어나오기 시작합니다. 단쇄상 구조, 복쇄상 구조, 층상 구조, 망상 구조의 규산염 광물들인데, 보웬의 반응계열에도, 조암광물에도 흔하게 언급되는 광물들이 죄다 여기에 있습니다. 가장 먼저 단쇄상 구조(또는 단사슬 구조)입니다. 지금까지 독립사면체, 복사면체, 환상구조는 규산염 사면체의 기본 단위가 연속적이지 않았습니다. 하지만 이들 광물 부터는 연속적으로 배열되고, 규산염 사면체 끼리의 결합에 참여하지 않고있는 산소들은 모조리 양이온들과 결합되어있습니다. 아래 그림은 단사슬 구조의 규산염 사면체의 구조입니다.
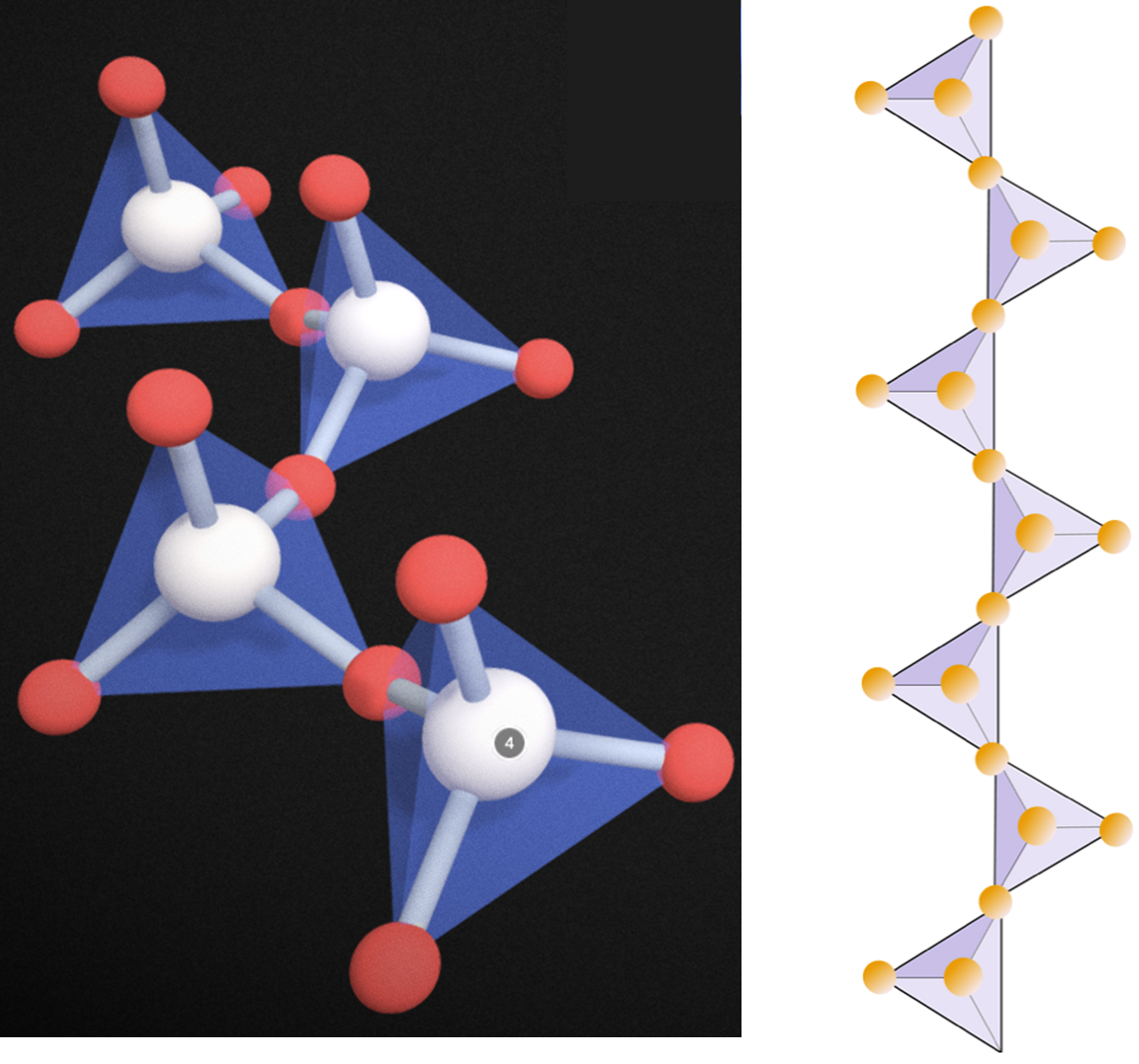
바로 저 단위 사슬 하나하나의 사이에 양이온이 자리를 잡고 있어, 사슬하나와 사슬 하나가 양이온을 사이에 두고 쭉 나열되어 있다 생각하시면 됩니다. 아래 그림처럼요.
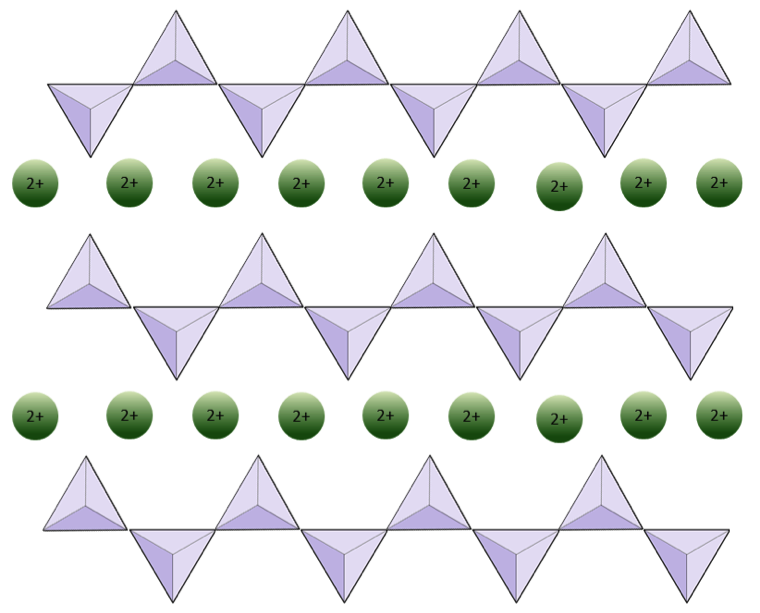
구조가 연속되어 있다고 Si : O의 비율을 따지는게 어려운건 아닙니다. 똑같이 단위 구조에 있는 Si와 O의 수를 세기만 하면 됩니다. 단사슬 구조의 경우 Si : O =1 : 3이 됩니다.
단사슬 구조의 가장 대표적인 사례가 휘석입니다. 엄청 유명한 광물이기 때문에, 한 번 쯤은 들어 보셨을 겁니다. 하지만 휘석의 경우 너무 다양한 세부 아종이 있습니다. 가장 유명한 아이가 단사휘석, 사방휘석 뭐 이런 아이들도 있고, 준휘석 이런 아이들도 있는데 다 아는 것은 전문가가 아닌이상 크게 의미가 없을 것 같습니다.
6. 복사슬구조(복쇄상구조)
단사슬 구조와 뚜렷한 차이가 있습니다. 단사슬 구조는 말 그대로 사슬이 1개. 복사슬 구조는 이런 사슬이 2개인 것입니다.
단사슬 구조에서 왼쪽 오른쪽의 산소는 그냥 양이온이랑만 결합했는데, 복사슬구조에서는 요 사슬간 산소가 또 공유하는 형태로 결합되어 있습니다. 마찬가지로 나머지는 모두 양이온과 결합하여 있고, 그 양이온은 다시 또 다른 복사슬 구조와 결합하여 있습니다. 이런 구조이다 보니 Si : O의 비율을 세어 보면 Si : O = 4 : 11이 됩니다. 이것 역시 단순하게 기본 구조에서부터 세어나가기 시작하면 되니 그리 어렵지는 않을 겁니다.
아래 링크는 각섬석의 3D 구조입니다. 3D로 보면 구조가 좀 복잡하지만, 자세히 째려보면, 1개의 복사슬 구조에 양이온(갈색)이 모조리 붙어 있고, 다시 이 양이온에 또다른 복사슬이 붙어있는것이 확인 됩니다.
Hornblende - 3D model by Earth Sciences, University of Newcastle - Sketchfab
Polyhedral model of the hornblende structure showing the monoclinic character. Si-tetrahedra (blue) form double chains parallel tothe Z-axis (vertical in the initial view). Iron and magnesium occupy the smaller (orange) octahedral sites, while calcium occu
sketchfab.com
복사슬 구조의 가장 대표적인 아이가 바로 각섬석입니다. 각섬석 역시 너무 종류가 다양하여, 그냥 각섬석으로 퉁 치기에는 범위가 너무 넓기는 합니다. 쪼개짐을 이야기 하며 가장 많이 비교되는 아이가 휘석과 각섬석입니다. (지난번에 휘석과 각섬석의 쪼개짐 각도에 관한 글을 쓴 적이 있으니 참고해 주세요)
광물의 깨짐과 쪼개짐
광물의 특성중 깨짐과 쪼개짐이라는 것이 있습니다. 이는 광물에 외력을 가했을 때 산산조각나는지 혹은 특정한 모양으로 박살나는지를 가지고 구분하는 기준입니다. 예를들어 흑운모는 종이
kalchi09.tistory.com
휘석의 경우 쪼개짐 각이 거의 90도임에 반해, 각섬석은 거의 120도 가량을 보입니다. 이같은 차이가 바로 단사슬이냐 복사슬이냐에서 오는 차이입니다.
7. 층상 구조(판상구조)
단사슬은 사슬 하나, 복사슬은 사슬 간 결합이었습니다. 층상구조는 이제 아예 가로방향으로, 그러니까 x,y방향(평면 방향)으로는 규산염 사면체가 모조리 붙어있고 z방향(연직 방향)으로는 양이온이 붙어있으며, 이 양이온은 다시 다른 판상구조와 붙어있는 상황이라 생각하면 됩니다. 대표적인 아이가 바로 잘 알려진 흑운모와 백운모입니다. 아래 그림은 대표적인 층상 구조인 백운모의 3D 모델입니다. 양이온이 들어갈 자리에 어떤 양이온이 들어가 있느냐에 따라 여러 형태의 광물이 나올 수 있습니다. 특히 보통 +2가의 전자가를 가지는 아이들 중 일부가 다른 전자가를 가지고 들어오면, 전자가가 안맞아 혼자는 못 들어가니 다른 양이온을 끌고 들어오기도 합니다. 이런 상황에 따라 여러가지 층상 구조의 광물이 나타날 수 있습니다. 흑운모와 백운모는 그런 얘중 대표적인 한 종류입니다.
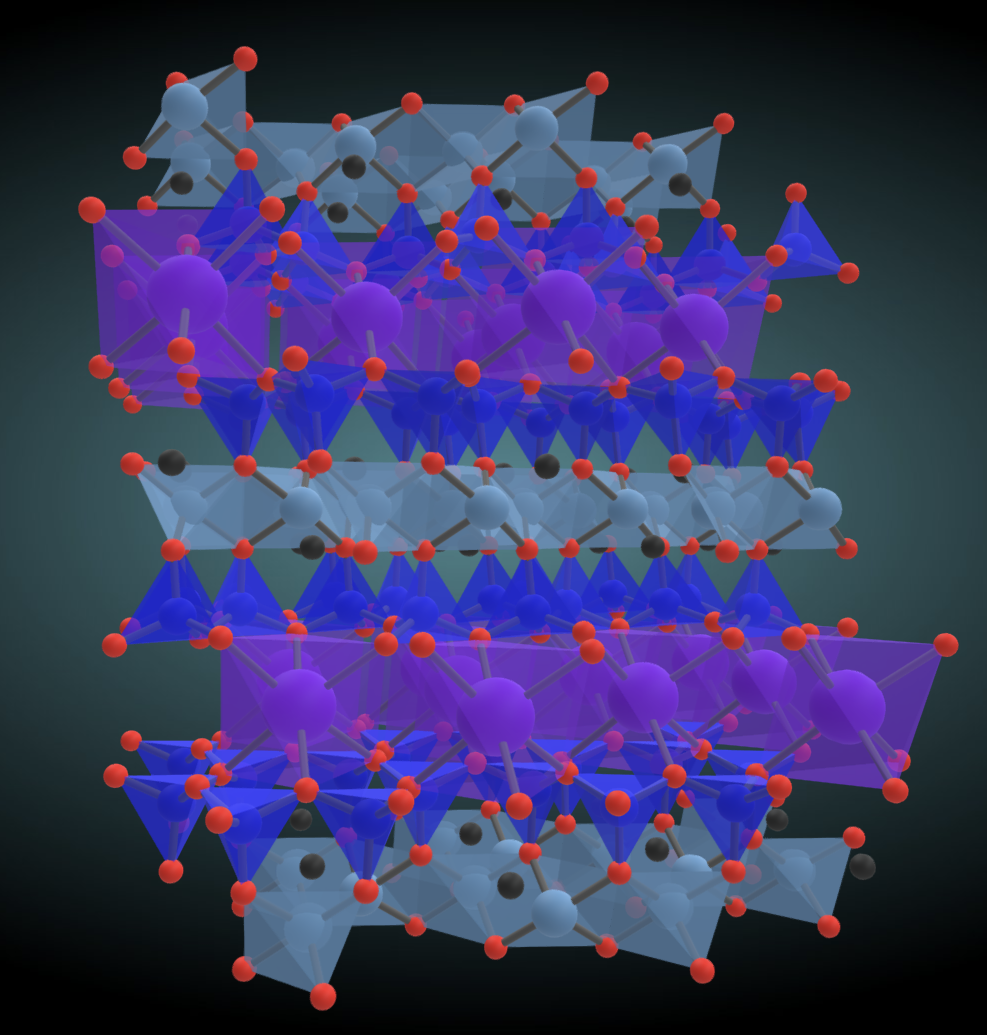
파란색 사면체가 규산염 사면체이고, 그 위로 양이온들이 덕지덕지 붙어있습니다. 양이온간 결합력은 산소를 공유하고 붙어있는 규산염 사면체간의 결합보다 약하기 때문에 외력을 가하면 1방향의 쪼개짐이 나타납니다.(이에 대한 지난 포스팅 참고해 주세요.)
Si : O의 비율은 마찬가지로 일일이 세어보면 금방 알 수 있습니다. Si : O = 6 : 15 = 2 : 5 가 나옵니다.
아래 링크에서 직접 보실 수 있습니다.
Muscovite - 3D model by Earth Sciences, University of Newcastle - Sketchfab
The structure of muscovite showing silicate tetrahedra (in blue) arranged in continuous sheets perpendicular to the z-axis (which is vertical in the initial view). Alumina octahedra (cyan) ar arranged in parallel sheets between vertices of the octahedra, w
sketchfab.com
8. 망상 구조
먼길 왔습니다. 이제 마지막인 망상구조입니다. 이제 광물은 어느 방향이건간에 규산염사면체의 모든 산소가 전부 다른 규산염 사면체와 산소를 공유하는 형태의 결합을 취하고 있습니다. 그 어느방향도 양이온과 붙어있지 않습니다. 그러다보니 다른 아이들과 다르게 규산염 사면체 구조 자체가 입체적인 모양을 띄고 있어 다소 복잡한 형태를 취하고 있기도 합니다만, 그럼과 동시에 가장 흔하게 관찰되는 광물들은 죄다 여기에 있다고 해도 과언이 아닙니다. 대표적인 아이가 잘 알려진 석영과 정장석입니다.
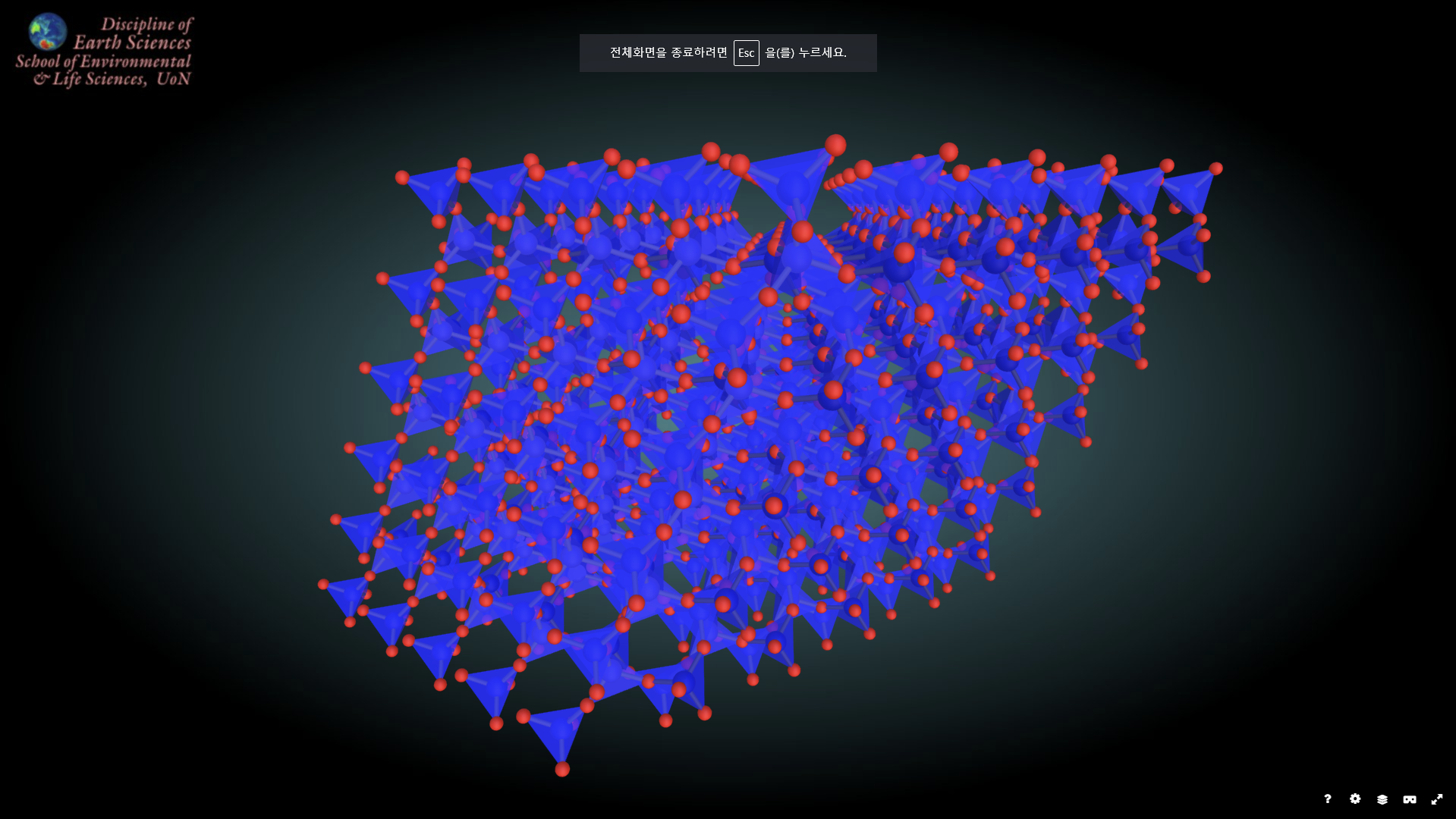
위의 그림이 석영인데, 말 그대로 사방의 모든 산소가 모두 규산염 사면체간 결합에 참여하고 있습니다.
정장석은 조금 재미있습니다. 정장석의 경우 규산염 사면체 안쪽의 규소가 Al(알루미늄)으로 치환된 경우인데, Si는 원자가가 +4이고, Al은 원자가가 +3이어서 맞지 않습니다. 그래서 이렇게 치환이 발생할 때 Al은 지혼자 Si 자리에 들어가지 않고, K같이 원자가가 +1인 아이를 업고 들어갑니다. 이렇게 함으로서 원자가를 맞추어 치환이 되고, 이렇게 Si가 Al과 K로 치환된 광물이 정장석입니다.
이상 규산염 광물의 내용을 요약하면

독립사면체부터 망상구조까지 모든 규산염 사면체의 3D 모델도 있습니다.

위 3D 모델을 볼 수 있는 곳의 주소를 아래 링크에 걸어 두었으니 한 번쯤 들어가서 보시는걸 추천합니다. 굉장히 다양한 모델이 만들어져있네요.
Structural linkage among silicate minerals #1 - 3D model by Museum of Mineralogy and Petrography, UAIC - Sketchfab
Silicate minerals are the most common, important and largest class of Earth’s minerals. The SiO4 tetrahedron (or SiO4 anionic group) is the basic building-block of silicate minerals. It is composed of one silicon ion (Si4+) (blue atom) surrounded by four
sketchfab.com
'교과서 밖 지구과학 > 지질' 카테고리의 다른 글
| 퇴적암 1 - 퇴적물과 퇴적작용 (1) | 2022.09.20 |
|---|---|
| 지구 내부 탐사의 원리 - 중력 이상 (0) | 2022.08.23 |
| 변환 단층이 생기는 이유(해령이 끊어져 있는 이유) (6) | 2022.06.16 |
| 고지자기 해석의 기초 - 편각, 복각과 자기극의 이동 (3) | 2022.06.07 |
| 고지자기 해석의 기초 - 편각과 복각 (9) | 2022.06.07 |




댓글